Dióxido de Cloro
El Clorito de Sodio (NaClO2) es un precursor para la generación de dióxido de cloro (ClO2), un compuesto de cloro con gran capacidad biocida, de uso exclusivo en la potabilización y depuración de agua. El Dióxido de Cloro está incluido en el art. 95 del Reglamento EU 528/2012 de biocidas como sustancia activa.
El ClO2 tiene un tiempo de vida medio corto una vez generado, por lo que la manera más habitual de obtenerlo es in situ, a través de la mezcla de Clorito de sodio, líquido o granulado, con un ácido débil.
Propiedades del CLO2
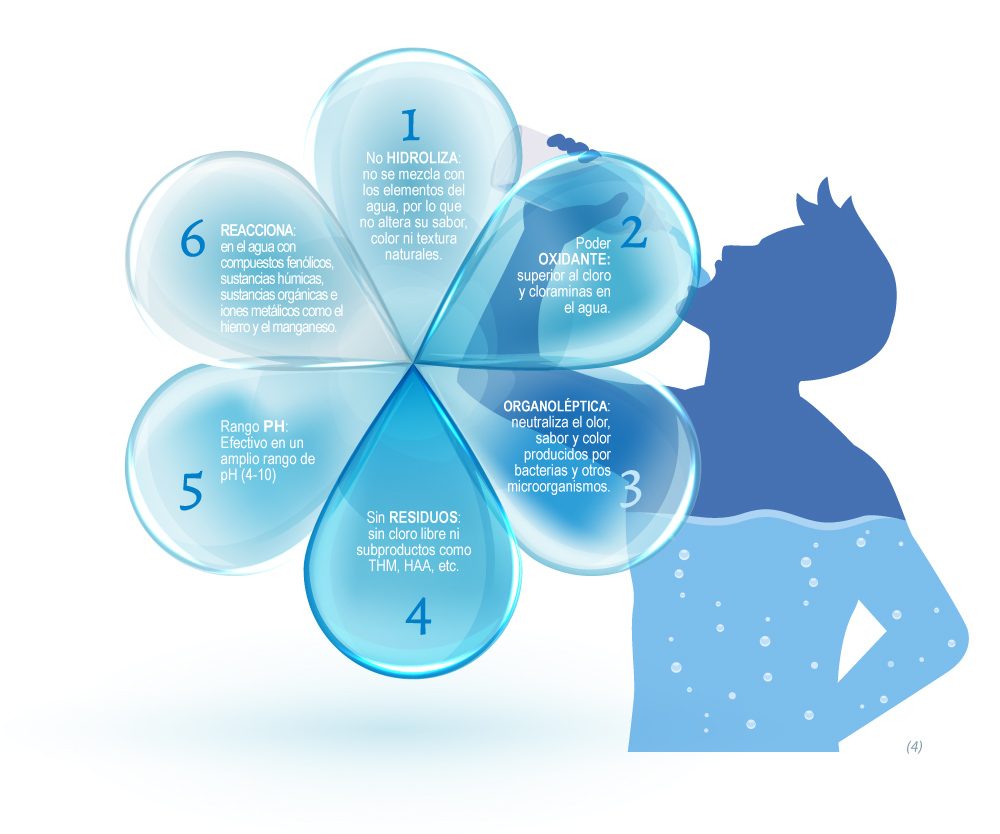
El dióxido de cloro está siendo usado desde 1944 para el tratamiento de aguas en las estaciones depuradoras públicas de todo el mundo. Debido a sus cualidades oxidantes selectivas, su aplicación es una alternativa a ser considerada donde además de la desinfección se requiere mejorar la calidad organoléptica del agua.
Además, es capaz de eliminar el hierro y el manganeso y otros compuestos que confieren color y sabor.(1)
Los estudios demuestran que es más eficaz como desinfectante que el cloro en todas las circunstancias contra agentes patógenos presentes en el agua, como virus, bacterias y protozoos. (2)
Por otro lado, a diferencia de otros productos, el dióxido de cloro es efectivo en un rango muy amplio de valores de pH (4-10) (3)(5). Su poder de oxidación es superior al cloro, a la cloramina y al yodo, y es mucho mejor que el ozono en aguas ya contaminadas debido a su eficacia en bajas concentraciones. Además, su elevada solubilidad en agua le permite actuar durante un período de tiempo, lo que supone una gran ventaja respecto al ozono, que se evapora al instante y necesita de una aplicación constante en el tiempo. (4)
Una de las principales ventajas del uso de dióxido de cloro es que reduce la formación de subproductos orgánicos dañinos para las personas y el medio ambiente como los trihalometanos (THM) y las cloraminas. (4)
El dióxido de cloro en cantidades suficientes es capaz de oxidar los compuestos fenólicos (7): La contaminación por BPA (bisfenol-A) procedente de plásticos, provoca daños en el organismo. El único grupo funcional del BPA son dos alcoholes, que, si se oxidan, podría provocar que el BPA no tuviese ese efecto tóxico. Aún no se ha elucidado el mecanismo de acción del BPA, por lo tanto, no se puede atribuir su efecto a los grupos funciónales.
Además, el ClO2 no reacciona con el amoníaco o las aminas primarias y secundarias, lo que evita aumentar la demanda de cloro en los sistemas de distribución. (6)
- Volatilidad: en estado gaseoso es muy volátil.
- Solubilidad: una de sus principales características es su alta solubilidad en un medio acuoso, lo que representa una gran ventaja ante otras sustancias como el ozono.
- Licuefacción: pasa a estado líquido a bajas temperaturas, pero puede volver a estado gaseosos al alcanzar los 11º.
- Densidad: presenta una densidad mayor a la del agua y el aire.
- Origen sintético: no es posible hallarlo en la naturaleza. Cuando se mezcla en soluciones acuosas puede ser disipado con procesos de aireación, ya que no se hidroliza.
- Color: verde amarillento.
- Disuelve fácilmente emulsiones e hidrocarbonos, por lo que puede atravesar las capas de las bacterias.
- Biofilm: el ClO2 oxida la matriz de polisacáridos que une el biofilm. El dióxido de cloro se transforma en iones de cloruro, que se divide a su vez en partes de biofilm que se conservan estables. Cuando el biofilm comienza a desarrollarse nuevamente, se crea una ambiente ácido que permite la nueva generación de dióxido de cloro y la eliminación total del biofilm restante.
VENTAJAS
- Obtención de agua de gran pureza, libre de sustancias no deseadas.
- Más potente que el Cloro en un tiempo de contacto corto.
- Mayor poder de oxidación, lo que favorece la eliminación de olores, colores y sabores.
- No produce trihalometanos (THM) ni cloraminas.
- No se ve afectado por las variaciones de pH.
- Mejora la eliminación del hierro y el manganeso.
- Controla la acumulación de limo en depósitos de agua.
- Es capaz de oxidar compuestos fenólicos.
- Es biodegradable.
DESVENTAJAS
- Es un poco más caro que el Cloro.
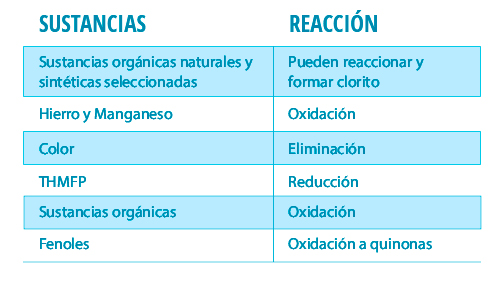
*Efectos del ClO2 en el tratamiento del agua potable (4)
Breve reseña histórica de CLO2
El Dióxido de Cloro fue descubierto por Sir Humphrey Davy en 1814. Por aquel entonces no tuvo mucho éxito en aplicaciones industriales ni en tratamiento de aguas debido a la dificultad de manipulación que entrañaba.
En 1944 se utiliza por primera vez en una estación de agua potable a gran escala.
En 1955 se extiende su uso en EEUU para tratamiento de agua de consumo humano.
Fue estabilizado hace 20 años en laboratorios de E.E.U.U.
A día de hoy, el uso del Dióxido de Cloro sigue aumentando de forma exponencial en todo el mundo, tanto en el tratamiento y potabilización de aguas, el control de olores en aguas residuales, la conservación de productos orgánicos o en el control de biofilm.
A otro nivel, el ClO2 es usado en industrias y comercios, sobre todo en el sector alimenticio, para la limpieza e higienización de maquinaria e instalaciones. Su persistencia en el tiempo lo hace completamente efectivo en la eliminación del biofilm presente en estos equipos e instalaciones. A todas las propiedades anteriormente descritas, se une la baja tasa de corrosión en tuberías de hierro fundido.
Reconocimientos oficiales del Dióxido de Cloro

Food & Drug Association E.E.U.U
Aprueba su uso y reconoce su acción biocida dirigida a microorganismos, destruyendo su pared de intercambio celular y eliminando así cualquier amenaza bacteriana, viral o fúngica que pueda afectar a la salud de las personas.

Environmental Protection Agency E.E.U.U
El Dióxido de Cloro está registrado en la EPA con el número de registro 74986-1. Ha pasado las estrictas pautas dis/tiss para su uso como desinfectante de superficies de contacto con alimentos.

Asociación Internacional de Transporte Aéreo
En su guía "Material de Orientación General para las Operaciones en Rampa durante el COVID19", recomienda el uso de dióxido de cloro en tanques de agua llenos almacenados, para prevenir la contaminación del agua por microorganismos.

Departamento de Agricultura E.E.U.U
Aprueba el Dióxido de Cloro y el Clorito de Sodio para su uso en plantas de procesamiento de alimentos para desinfección y control de bacterias y hongos.

Unión Europea
El ClO2 ha sido incluido en el artículo 95 del Reglamento EU 528/2012 de Biocidas.

Robert Koch Institut
Ha sido certificado por el Robert Koch Institut, lo que significa que cuenta con un 99% de efectividad en la destrucción de gérmenes (efectividad nivel A-D) asociados a la desinfección de agua potable, áreas en general, consumo humano y animal.
Reconocimientos oficiales del Dióxido de Cloro
(1) United States Environmental Protection Agency (2020). Welcome to the Drinking Water Treatability Database. US.https://iaspub.epa.gov/tdb/pages/treatment/treatmentOverview.do?treatmentProcessId=-1277754943
(2) Ogata, N., & Shibata, T. (2008). Protective effect of low-concentration chlorine dioxide gas against influenza A virus infection. Journal of General Virology, 89(1), 60 67. doi:10.1099/vir.0.83393-0 .
(3) Chauret, C.P., Radziminski, C.Z., Lepuil, M., Creason, R., Andrews, R.C., 2001. Chlorine dioxide inactivation of Cryptosporidium parvum oocysts and bacterial spore indicators. Appl. Enviro. Microbiol. 67 (7), 2993–3001.
(4) Deininger RA, Ancheta A, Ziegler A. Desinfección con dioxido de cloro. Simposio regional sobre calidad del agua: desinfección efectiva. CEPIS/OPS. Lima. 1998; 1-14.
(5) Aieta, E. M., & Berg, J. D. (1986). A Review of Chlorine Dioxide in Drinking Water Treatment. Journal - American Water Works Association, 78(6), 62–72. doi:10.1002/j.1551-8833.1986.tb05766.x
(6) Francisco Ramírez Quirós (2005).Tratamiendo de Desinfección del Agua Potable. Departamento de tratamiento del agua. Canal de Isabel II. España. https://www.fundacioncanal.com/canaleduca/wp-content/uploads/2015/08/Tratamiento-de-desinfeccion-del-agua-potable2.pdf
(7) Stevens, A. A. Reaction products of chlorine dioxide. Environ. Health Perspect. Vol. 46, 101–110 (1982)