Dioxyde de chlore
Le chlorite de sodium (NaClO2) est un précurseur pour la production de dioxyde de chlore (ClO2), un composé chloré à fort pouvoirbiocide exclusivement utilisé dans la purification de l'eau et le traitement de l'eau potable. Le dioxyde de chlore est inclus dans l'article 95 du règlement 528/2012 de l'UE sur les produits biocides en tant que substance active.
Le ClO2 a une demi-vie courte une fois qu'il est généré, de sorte que la manière la plus courante de l'obtenir est in situ, en mélangeant du chlorite de sodium, liquide ou granulé, avec un acide faible.
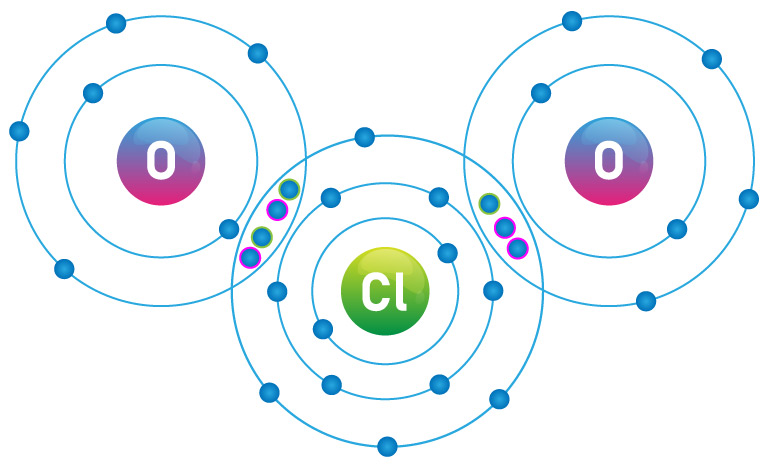
Propriétés du CLO2
Le dioxyde de chlore est utilisé depuis 1944 pour le traitement de l'eau dans les stations d'épuration publiques du monde entier. En raison de ses qualités d'oxydation sélective, son application est une alternative à considérer lorsque, en plus de la désinfection, la qualité organoleptique de l'eau doit être améliorée.
En outre, il est capable d'éliminer le fer et le manganèse ainsi que d'autres composés qui donnent de la couleur et de la saveur(1).
Des études montrent qu'en tant que désinfectant, il est plus efficace que le chlore en toutes circonstances contre les agents pathogènes véhiculés par l'eau tels que les virus, les bactéries et les protozoaires (2).
En revanche, contrairement à d'autres produits, le dioxyde de chlore est efficace sur une très large gamme de pH (4-10)(3)(5). Son pouvoir d'oxydation est supérieur à celui du chlore, de la chloramine et de l'iode, et il est bien meilleur que l'ozone dans les eaux déjà polluées grâce à son efficacité à faible concentration. De plus, sa grande solubilité dans l'eau lui permet d'agir pendant un certain temps, ce qui est un grand avantage par rapport à l'ozone, qui s'évapore instantanément et nécessite une application constante dans le temps (4).
L'un des principaux avantages de l'utilisation du dioxyde de chlore est qu'il réduit la formation de sous-produits organiques nocifs pour l'homme et l'environnement, tels que les trihalométhanes (THM) et les chloramines (4).
Le dioxyde de chlore en quantités suffisantes est capable d'oxyder les composés phénoliques. (7) : La contamination par le BPA (bisphénol-A) provenant des plastiques cause des dommages à l'organisme. Le seul groupe fonctionnel du BPA est constitué de deux alcools qui, s'ils sont oxydés, pourraient rendre le BPA non toxique. Le mécanisme d'action du BPA n'a pas encore été élucidé et son effet ne peut donc pas être attribué à des groupes fonctionnels.
En outre, le ClO2 ne réagit pas avec l'ammoniac ou les amines primaires et secondaires, ce qui évite d'augmenter la demande de chlore dans les systèmes de distribution. (6)
- Volatilité : très volatile à l'état gazeux.
- Solubilité : l'une de ses principales caractéristiques est sa grande solubilité en milieu aqueux, ce qui constitue un grand avantage par rapport à d'autres substances telles que l'ozone.
- Liquéfaction : devient liquide à basse température, mais peut revenir à l'état gazeux à 11°C.
- Densité : la densité est plus élevée que celle de l'eau et de l'air.
- Origine synthétique : ne se trouve pas dans la nature. Lorsqu'il est mélangé à des solutions aqueuses, il peut être dissipé par des processus d'aération, car il ne s'hydrolyse pas.
- Couleur : vert jaunâtre.
- Dissout facilement les émulsions et les hydrocarbures, ce qui lui permet de traverser les couches bactériennes.
- Biofilm : le ClO2 oxyde la matrice de polysaccharides qui lie le biofilm. Le dioxyde de chlore est transformé en ions chlorure, qui à leur tour se divisent en parties du biofilm qui restent stables. Lorsque le biofilm recommence à se développer, un environnement acide est créé, ce qui permet une nouvelle génération de dioxyde de chlore et l'élimination complète du biofilm restant.
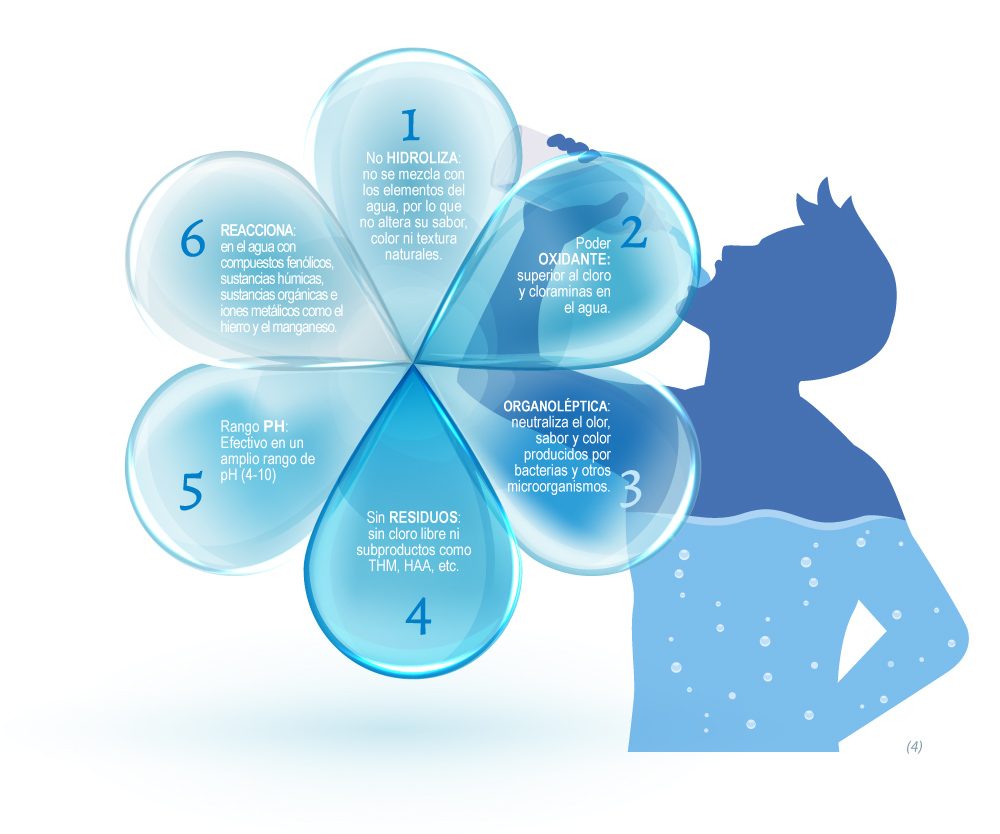
AVANTAGES
- Obtention d'une eau de grande pureté, exempte de substances indésirables.
- Plus puissant que le chlore dans un temps de contact court.
- Pouvoir d'oxydation plus élevé, ce qui favorise l'élimination des odeurs, des couleurs et des saveurs.
- Il ne produit pas de trihalométhanes (THM) ni de chloramines.
- Insensible aux variations de pH.
- Améliore l'élimination du fer et du manganèse.
- Contrôle l'accumulation de limon dans les réservoirs d'eau.
- Il est capable d'oxyder les composés phénoliques.
- Il est biodégradable.
INCONVÉNIENTS
- Il est légèrement plus cher que le chlore.
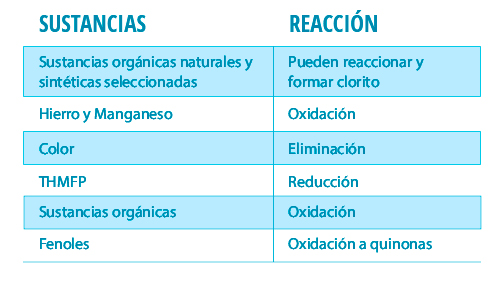
*Effets du ClO2 sur le traitement de l'eau potable(4)
Brève histoire du CLO2
Le dioxyde de chlore a été découvert par Sir Humphrey Davy en 1814. À l'époque, il n'avait pas beaucoup de succès dans les applications industrielles ou dans le traitement de l'eau en raison de la difficulté à le manipuler.
En 1944, il a été utilisé pour la première fois dans une station d'eau potable à grande échelle.
En 1955 se extiende su uso en EEUU para tratamiento de agua de consumo humano.
Il a été stabilisé il y a 20 ans dans des laboratoires américains.
Aujourd'hui, l'utilisation du dioxyde de chlore continue de croître de manière exponentielle dans le monde entier, que ce soit pour le traitement et la purification de l'eau, le contrôle des odeurs dans les eaux usées, la préservation des produits organiques ou le contrôle des biofilms.
Par ailleurs, le ClO2 est utilisé dans l'industrie et le commerce, en particulier dans le secteur alimentaire, pour le nettoyage et l'assainissement des machines et des installations. Sa persistance dans le temps lui confère une efficacité totale dans l'élimination du biofilm présent dans ces équipements et installations. Outre toutes les propriétés décrites ci-dessus, les tuyaux en fonte présentent également un faible taux de corrosion.
Reconnaissances officielles du dioxyde de chlore

Food & Drug Association E.E.U.U
Elle approuve son utilisation et reconnaît son action biocide sur les micro-organismes, détruisant leur paroi cellulaire et éliminant ainsi toute menace bactérienne, virale ou fongique pour la santé humaine.

Agence pour la protection de l'environnement E.E.U.U.
Le dioxyde de chlore est enregistré auprès de l'EPA sous le numéro 74986-1. Il a satisfait aux directives strictes de dis/tiss pour être utilisé comme désinfectant des surfaces en contact avec les denrées alimentaires.

Association internationale du transport aérien
Dans son document "General Guidance Material for Ramp Operations during COVID19", elle recommande l'utilisation de dioxyde de chlore dans les réservoirs d'eau pleins stockés afin de prévenir la contamination de l'eau par des micro-organismes.

Département de l'agriculture des États-Unis
Approuve l'utilisation du dioxyde de chlore et du chlorite de sodium dans les usines de transformation des aliments pour la désinfection et la lutte contre les bactéries et les champignons.

Union européenne
Le ClO2 a été inclus dans l'article 95 du règlement 528/2012 de l'UE sur les produits biocides.

Institut Robert Koch
Il a été certifié par l'Institut Robert Koch, ce qui signifie qu'il a une efficacité de 99 % dans la destruction des germes (niveau d'efficacité A-D) associés à la désinfection de l'eau potable, des zones générales, de la consommation humaine et animale.
Reconnaissances officielles du dioxyde de chlore
(1) United States Environmental Protection Agency (2020). Welcome to the Drinking Water Treatability Database. US.https://iaspub.epa.gov/tdb/pages/treatment/treatmentOverview.do?treatmentProcessId=-1277754943
(2) Ogata, N., & Shibata, T. (2008). Effet protecteur du dioxyde de chlore gazeux à faible concentration contre l'infection par le virus de la grippe A. Journal of General Virology, 89(1), 60 67. doi:10.1099/vir.0.83393-0 .
(3) Chauret, C.P., Radziminski, C.Z., Lepuil, M., Creason, R., Andrews, R.C., 2001. Chlorine dioxide inactivation of Cryptosporidium parvum oocysts and bacterial spore indicators. Appl. Enviro. Microbiol. 67 (7), 2993–3001.
(4) Deininger RA, Ancheta A, Ziegler A. Desinfección con dioxido de cloro. Simposio regional sobre calidad del agua: desinfección efectiva. CEPIS/OPS. Lima. 1998; 1-14.
(5) Aieta, E. M., & Berg, J. D. (1986). A Review of Chlorine Dioxide in Drinking Water Treatment. Journal - American Water Works Association, 78(6), 62–72. doi:10.1002/j.1551-8833.1986.tb05766.x
(6) Francisco Ramírez Quirós (2005).Tratamiendo de Desinfección del Agua Potable. Departamento de tratamiento del agua. Canal de Isabel II. España. https://www.fundacioncanal.com/canaleduca/wp-content/uploads/2015/08/Tratamiento-de-desinfeccion-del-agua-potable2.pdf
(7) Stevens, A. A. Reaction products of chlorine dioxide. Environ. Health Perspect. Vol. 46, 101–110 (1982)